- Máte dotazy?
- +420 606 417 244
- hkubes@med.muni.cz
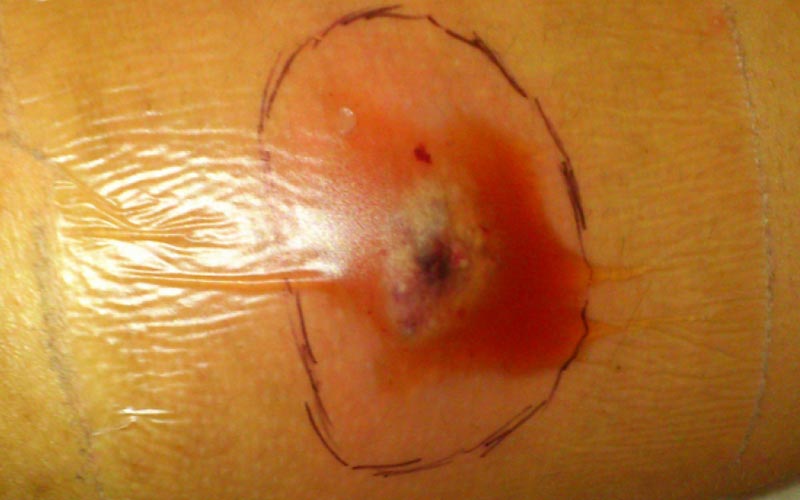
Poruchy integrity kůže
24 února, 2018Stárnutí z hlediska patofyziologie

Názory na příčiny a vlastní proces stárnutí procházejí trvalým vývojem formovaným postupem lidského poznání. Úroveň našich znalostí se posouvá stále hlouběji do celulárních a subcelulárních struktur a tento posun reflektuje i vývoj teorií stárnutí.
Porovnáme-li výklad jednotlivých starších terorií s novějšími poznatky, musíme přiznat starším autorům, že se ve svých předpokladech zásadním způsobem nemýlili, jen ve své době ještě neměli dostatek informací k preciznějšímu vyjádření, stejně jako generace budoucí zcela jistě zdokonalí předpoklady a teorie současné.
Stárnutí a buňka
Zkoumání příčin a patofyziologických mechanizmů stárnutí, ale i některých chorob vedly ke zjištění podobností, z nichž nejvýraznější je tzv. laminopatie A/C způsobená mutací strukturálního proteinu jaderné membrány laminu. Tato mutace byla původně prokázána u onemocnění svalové buňky skeletální nebo myokardiální.
Další poznatky odhalily projevy laminopatie v různé intenzitě postihující také buňky nervové, tukové, kostní, jaterní, kožní a tyto projevy byly velmi podobné projevům předčasného stárnutí. Tradičně se hovoří v souvislosti se stárnutím buňky o kumulaci poškození DNA, proteinů, membrán a organel – i v tomto pojetí je nacházena podobnost se změnami doprovázejícími průběh některých chorob.
Neschopnost organizmu reparovat tyto změny je považován ze konečný důsledek mnoha možných příčin stárnutí.
Nejvíce pozornosti je v posledních letech věnováno oxidativnímu stresu. Ten je považován za jeden z hlavních faktorů působících na dlouho žijící postmitotické buňky. Efekt dlouhodobého působení se projeví především na mitochondriích – dochází k deterioraci enzymatického vybavení a z toho plynoucí poruše v zásobování dalších buněčných struktur energetickými substráty.
Tomuto mechanizmu je přičítána zpomalená reparace svaloviny myokardu po zátěži či stresu ve vyšším věku. Morfologickým obrazem tohoto procesu je vznik tzv. obrovských „giant“ mitochondrií.
Tématika volných kyslíkových radikálů je studována i z hlediska možnosti využití antioxidantů ke kontrole jejich produkce. Fibrilární i granulární nukleolární struktury i perichromatin byly v experimentu postiženy podobně v průběhu stárnutí i za podmínek deficitu vitaminu E. Toto zjištění je možno považovat za další potvrzení významu volných kyslíkových radikálů a možného přínosu snížení jejich produkce pro prodloužení života buňky.
S prodlužující se délkou života buňky klesá i schopnost exprese tzv. heat shock proteinu (HSP) 47, který je za normálních okolností ochráncem (chaperon) třídimenzionální struktury prokolagenu. Pokles schopnosti sekrece HSP 47 vede k hromadění defektů struktury prokolagenu.
Myokard a stárnutí
Myokardiální buňka má limitované možnosti neutralizovat oxidační stres. Postupem času se kumuluje poškození mitochondriální DNA, a tím i enzymů dýchacího řetezce, důsledkem je narůstající porucha diastolické i systolické funkce komor. V experimentu působily podpůrně na myokardiální buňku látky jako je koenzym Q 10, omega 3 – nenasycené mastné kyseliny, Mg-orotat či kyselina lipoová. Významný vliv na efektivitu metabolizmu myokardiální buňky mělo systematické cvičení spojené s redukcí stresu. Ejekční frakce během cvičení stoupá stejně jako v mladším věku, rezerva ejekční frakce však s věkem klesá.
Kosterní sval a pohybový systém ve stáří
Kumulující se poškození mitochondriálních dýchacích řetězců, projevující se převážně mechanizmem poklesu aktivity v transportu elektronů, je jedním z hlavních zdrojů volných kyslíkových radikálů. Dodávka L-carnitinu zvýšila v experimentu intenzitu transportu elektronů ve svalových buňkách starých myší a zlepšila energetické poměry jejich svalových buněk na úroveň mladších jedinců.
Ztráta svalové hmoty a funkce svalu – sarkopenie – je v popředí zájmu v souvislosti s vyplývajícími zdravotními a socioekonomickými aspekty stárnutí. Hormon IGF-I je považován za hlavní faktor regulující množství vytvářené svalové hmoty. Experimenty však ukazují, že hormon IGF-I má několik částí, z nichž jedna reaguje na mechanickou zátěž.
Tato část byla nazvána mechanogrowth factor (MGF). MGF zahrnuje odlišné konsekvence peptidů a je odpovědný za aktivaci růstu svalových buněk. Tato zjištění nabízí do budoucna možnost předcházení či řešení sarkopenie u starších jedinců dodávkou MGF, diskutována je i možnost genové terapie.
V posledních letech je diskutováno i poškození nervosvalové junkce jako faktoru urychlujícího rozvoj sarkopenie.
Stárnutí chrupavky podmiňuje vývoj osteoartrózy jako nejčastější příčiny chronické bolesti a disability seniorů. Již dlouhou dobu je znám fakt, že tkáň chrupavky se vyznačuje jen pomalou obměnou a přitom je po celou dobu života vystavena mechanickému namahání. V tkáni chrupavky se s postupujícím věkem hromadí konečné produkty glykace (advanced glycation end products – AGEs) a v současné době je studován jejich podíl na vzniku vlastní osteoartrózy. I v této oblasti je zvažována role oxidačního střesu na urychlení stárnutí chondrocytu. Výsledkem je snížení až ztráta schopnosti chondrocytu a celé tkáně odolávat mechanickému zatížení.
Vzhledem k aktuálnímu zastoupení osteoartrózy v populaci seniorů (60-70%) je věnována velká pozornost předcházení jejích důsledků – tedy dysabilitě, závislosti na pomoci okolí, dysmobilitě a pádům, chronické bolesti a depresi. Za nejefektivnější přístupy zlepšující kvalitu života seniorů s osteoartrózou a snižující výskyt pádů jsou považovány: udržení a zlepšování kondice, snížení zátěže pohybového aparátu, adekvátní diagnostika a léčba bolesti.
Neuron a mozek ve stáří
V mozkové tkáni jako celku dochází ke změnám v průběhu celého života jedince a autoři si dokonce kladou otázku, kdy je ukončen proces zrání mozku a kdy nastává etapa jeho stárnutí. Současné technické možnosti poskytují mnoho obrazů, jejichž přesná interpretace bude patrně možná teprve s odstupem času. Stárnutí vede ke změnám v distribuci šedé hmoty, dále k regionálním změnám, jejichž postupná analýza napomáhá objasnit vztah mezi kognitivními změnami a jejich morfologickým korelátem.
Změny v bílé hmotě mozkové jsou detekovány jako léze (white matter lesion – WML) a dlouhou doby byly považovány za změny pouze doprovázející vyšší věk bez většího klinického významu. Postupně však byla odhalena koincidence s hypertenzí, depresí, zvýšeným kardiovaskulárním rizikem, močovou inkontinencí a kognitivními poruchami. Z hlediska lokalizace jsou léze bílé hmoty nejčastěji nacházeny v okcipitální a temporální oblasti.
Celkově lze říci, že stárnoucí mozek je nucen se adaptovat na kumulující se poškození způsobené nejvýrazněji oxidačním stresem a mechanizmy zánětu. Adaptace probíhá prostřednictvím neuroprotektivních a neuroreparačních mechanizmů, které mohou být zvenčí podpořeny dodávkou antioxidantů (např. v podobě vitaminu E a vitaminu C) nebo protizánětlivých působků (např. omega-3 polynesaturované mastné kyseliny). Nepříznivý vliv nízkého příjmu antioxidantů a produktů mořských ryb byl prokázán v podobě vyššího výskytu kognitivních poruch. Stejný dlouhodobý efekt měla i vysoká sérová hladina homocysteinu. Jako podpůrný faktor nárůstu homocysteinu je zvažován nízký příjem vitaminu B12 a kyseliny listové.
Imunitní systém ve stáří
Funkce monocytů a granulocytů je ve stáří podstatným způsobem změněna. Nejvýraznější role je v této oblasti připisována leukocytárním adhezivním molekulám, které za běžných podmínek zprostředkovávají široké spektrum imunitních reakcí. Snížená exprese těchto molekul na povrchu granulocytů a monocytů se ve stáří může podílet na dysfunkci imunitního systému – snížená adhesivita vede k celkově snížené odpovědi na akutní zánětlivé podněty, a to může vysvětlovat zvýšenou citlivost starších nemocných k infekcím obecně.
V populaci lymfocytů je ve starším věku možno detekovat rostoucí podíl T lymfocytů s povrchovým antigenem CD 8, jejichž cytokiny mají supresivní efekt na celkovou imunokompetenci i na homeostázu kostní dřeně. Nejkřehčí je z tohoto pohledu protivirová imunita. Imunomodulace populace T lymfocytů by se mohla stát součástí komplexní léčebné strategie předcházející mnoha komplikacím vyššího věku.
Další sledovanou oblastí je schopnost remodelace imunitní odpovědi za stresových podmínek považovanou za jednu ze základních podmínek úspěšného stárnutí. Tato remodelace je zprostředkována v mladším věku kolísáním produkce IL-6, ve vyšším věku je produkce tohoto cytokinu konstantní, což vede k poruchám uvolňování zinkových iontů z jejich bílkovinné vazby. Nízká dostupnost zinku potom negativně ovlivňuje thymickou i extrathymickou složku imunitní reakce.
Respirační systém ve stáří
Se stoupajícím věkem je popisována redukce katecholaminergního zásobení hladké svaloviny trachey a bronchiálního stromu. Stárnutí se dále projevuje změnami mechanických vlastností stěny hrudníku i vlastní plicní tkáně ve smyslu poklesu elasticity, proti očekávání však v téže studii nebylo prokázáno zvýšení statické práce dýchacích svalů při nádechu, a to v klidu ani při zátěži. Tento jev je vysvětlován redistribucí daného množství vykonané práce na více okolních tkáňových struktur. Aplikace systematické tělesné aktivity ke zpomalení ztráty elasticity však nevedla k znatelnému výsledku.
Nejzávažnějším aspektem vztahu věku a respiračního traktu jsou infekce, které jsou jednou z hlavních příčin mortality starších nemocných. Zvýšený výskyt respiračních infekcí u starších nemocných je podmíněn multifaktoriálně – v popředí stojí slábnoucí imunitní reakce a přítomnost dalších chorob podmiňujících mnohočetné orgánové dysfunkce. Podstatné jsou i sociální vlivy – nemocní v institucích jsou podstatně častěji ohroženi závažnými recidivujícími respiračními infekty.
Trávicí trakt ve stáří
Se zvyšujícím se věkem dochází ke ztenčení mukózy a ke snížení produkce slin – tento jev se může podílet na polykacích obtížích při pseudobulbárním syndromu, nelze však opomíjet ani vliv medikamentů s vedlejšími účinky charakteru suchosti v ústech. Vlivem redukce myenterického plexu dochází ke zpomalení motility celého trávicího traktu – je nutno kalkulovat s delší dobou kontaktu jak potravy tak podaných medikamentů se slizničním povrchem, a tedy i intenzivnějším projevům lokálního dráždění. Dále klesá produkce žaludeční kyseliny, tedy stoupá pH žaludku, což může ovlivnit resorpci léků, vytváři neodpovídající podmínky pro působení trávicích enzymů, a tedy nedokonalé trávení živin. Důsledkem může být dyskomfort, pocit plnosti, nadýmání, pocit dlouhodobého přetrvávání stravy v žaludku, nechutenství.
Snížení prokrvení v rámci aterosklerotických změn má za následek snížení resorpce živin i podaných medikamentů. Diagnosticky často opomíjená je klinicky manifestovaná porucha prokrvení – ischemická kolitida, či v podobě náhlé příhody břišní cévní ileus. Do epochy rutinního provádění koloskopií nebyl dostatečně známý fakt vysokého výskytu divertikulózy v populaci starších nemocných – ve věku nad 80 let se dokonce uvádí výskat divertiklů u 65% populace.
Hemopoéza a hemostáza ve stáří
Ve vyšším věku je nutno očekávat snížení rezervy kostní dřeně, tedy limitovanou možnost reakce na nejrůznější inzulty – např. akutní krvácení nebo akutní infekce. U řady nemocných se s postupujícím věkem objevují necharakteristické změny v hemopoéze, o jejichž příčinách zatím nemáme přesnější představu a které mohou vést k různým výkyvům parametrů periferního krevního obrazu i nálezu v kostní dřeni. U 5% starších nemocných je diagnostikován přímo myelodysplastický syndrom a u dalšího poměrně velkého procenta nemocných jsou nacházeny abnormality odpovídající možnému pozdějšímu vývoji této choroby.
Ve vzájemném vztahu hemostáza – krvácení (hyperkoagulace – hypokoagulace) je v mladším věku rovnováha, zatímco ve vyšším věku se tendence výrazně přesouvá ve prospěch hyperkoagulace zvýšením aktivity prokoagulačních faktorů a vlivu při zachování nebo mírném snížení aktivity antikoagulačních vlivů. Již samotná přítomnost aterosklerotických změn je považována na významný prokoagulační faktor svým narušením integrity cévní výstelky. U starších nemocných je hyperkoagulační stav dále podporován sníženým pocitem žízně, a tedy trvalou hypohydratací, a dlouhými epizodami imobilizace v rámci akutních zhoršení zdravotního stavu a následnou nutností dlouhodobé rekonvalescence.
K těmto běžným vlivům přistupuje ještě možnost pozdní manifestace vrozených defektů koagulačních faktorů – např. Leidenská mutace f. V, vyskytující se asi u 5% populace, ale pokud bychom aktivně pátrali u nemocných nad 60 let s první spontánní trombózou, výsledkem bude až 30% výskyt. Podobně je tomu i u defektů dalších faktorů – protein C, protein S – v klinické praxi se však ani u spontánních trombóz u starších nemocných po vrozených defektech nepátrá.
Klinické důsledky znamenají poměrně vysoké riziko tromboembolické nemoci u starších nemocných, a tedy nutno na možnost této komplikace myslet častěji. Důkazem pro toto tvrzení je poměr počtu plicních embolizaci diagnostikovaných in vivo a později autopticky. In vivo je diagnostikována plicní embolizace pouze desetiny nemocných z těch, u kterých je později embolizace diagnostikována autopticky.
Tendence k hyperkoagulaci je nejen ve vyšším věku, ale ve všech věkových kategoriích výrazně potencována přítomností malignity, kdy se předpokládá prokoagulační aktivita nádorových mediátorů. Spontánní vznik trombózy bez by měl vždy vést alespoň k základnímu screeningu onkologického onemocnění.
Autoři: Hana Matějovská Kubešová, Pavel Weber, Hana Meluzínová, Vlasta Polcarová, Jana Hrubanová , Klinika interní, geriatrie a praktického lékařství , Fakultní nemocnice a Lékařské fakulty MU v Brně